
期刊: cancer cell
影响因子:44.264
主要技术:scRNAseq ,Xenium,TF - seqFISH
导语
为了系统地绘制癌症发生过程中细胞状态的空间动态,需要进行高分辨率的空间转录组学分析。Xenium In Situ和TF - seq FISH平台已经成为两个开创性的高通量分析平台,用于在一个大的连续样本中绘制数百到数千个RNA靶标的亚细胞定位。它们能够以前所未有的单细胞分辨率对细胞结构和功能进行详细的可视化和空间分析,因此是研究肿瘤空间进化的理想工具。食管鳞状细胞癌( Esophageal squamous cell carcinoma,ESCC )是进行这种癌变时空研究的理想模型系统。食管具有特征性的空间结构,由一层分层的食管上皮基底层组成,其中含有对上皮更新有反应的干细胞。在这里,我们应用Xenium In Situ和TF - seqFISH空间转录组学平台,在食管组织切片上检测了1,536个独特的基因,并整合了单细胞RNA测序( scRNA-seq )数据,以系统地了解ESCC发展的连续阶段。
研究技术
scRNAseq ,Xenium,TF - seqFISH
核心技术创新
高分辨率空间转录组整合:
1.结合 Xenium In Situ(300基因/640万细胞/单细胞分辨率)和 TF-seqFISH(1,471基因/2.2万细胞/亚细胞分辨率)平台,首次实现食管鳞癌(ESCC)多阶段连续演化的空间动态可视化。匹配 scRNA-seq(38.5万细胞)数据,构建多层次细胞互作网络。
2.跨尺度样本设计:43例患者共127个视野(FOVs),覆盖正常(NOR)、低/高级别上皮内瘤变(LGIN/HGIN)和浸润癌(ESCC)阶段。6例患者的多阶段连续组织切片实现三维空间重构(如S1-1样本含NOR→LGIN→HGIN→ESCC连续区域)。
实验结果
1. 单细胞空间转录组学分析揭示了食管癌变过程中的动态细胞群
使用来自103 Genomics的Xenium In Situ平台进行了空间转录组学分析,为300个基因(图1A - 1C)在6,442,006个细胞中提供了单细胞分辨率分析。我们还将TF - seq FISH平台应用于另外两个包含NOR、LGIN和HGIN的组织玻片,在21,999个细胞上验证和扩展了Xenium In Situ空间转录组学分析的结果,该分析检测了Xenium In Situ鉴定的通路中的1,471个基因,此外,我们整合了来自143个多阶段样本的scRNA - seq数据,共包含385,151个细胞。这种综合的方法使我们能够在整个ESCC的发展过程中详细地研究细胞状态和细胞间的相互作用。
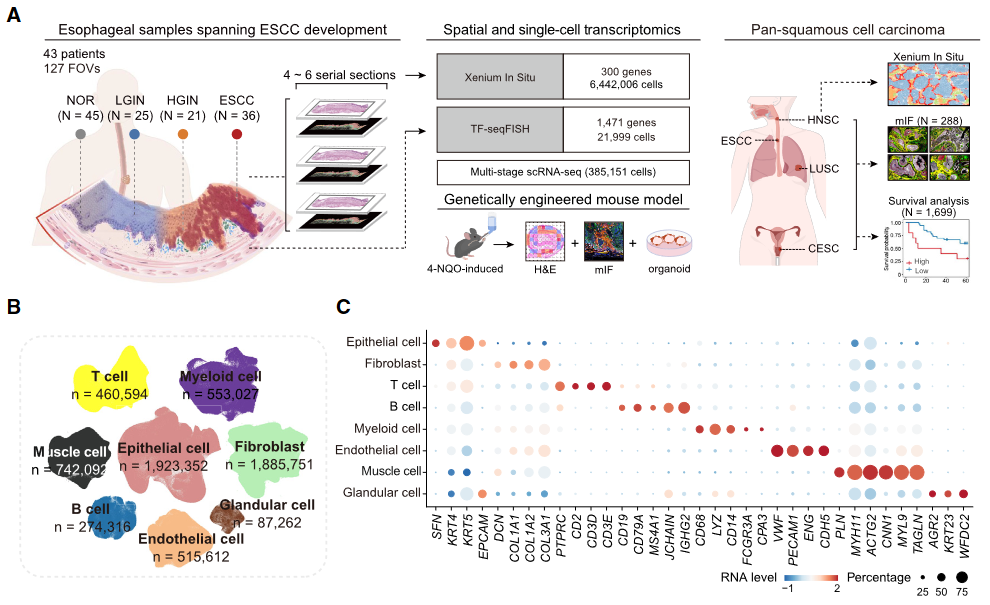
图1
2. 上皮细胞演化驱动癌变
四大亚群动态转换(Fig 2):基底层细胞(Basal):NOR阶段表达去分化基因(NOTCH1, COL17A1)。
增殖细胞(Proliferative):LGIN阶段扩增(占比从7.2%→22.2%, *p*=9.7e-7),激活细胞周期/炎症/DNA修复通路。侵袭细胞(Invasive):HGIN阶段出现(表达EMT基因MMP2/11、血管生成因子VEGFA/C),破坏上皮-间质界面(Fig 2C)。分化细胞(Differentiated):随着癌变比例骤减(NOR 86.7% → ESCC 4.8%)。去分化评分:基于43个食管特异性TF构建机器学习模型,证实侵袭细胞去分化程度接近基底层(Fig 3E)。
 图2
图2
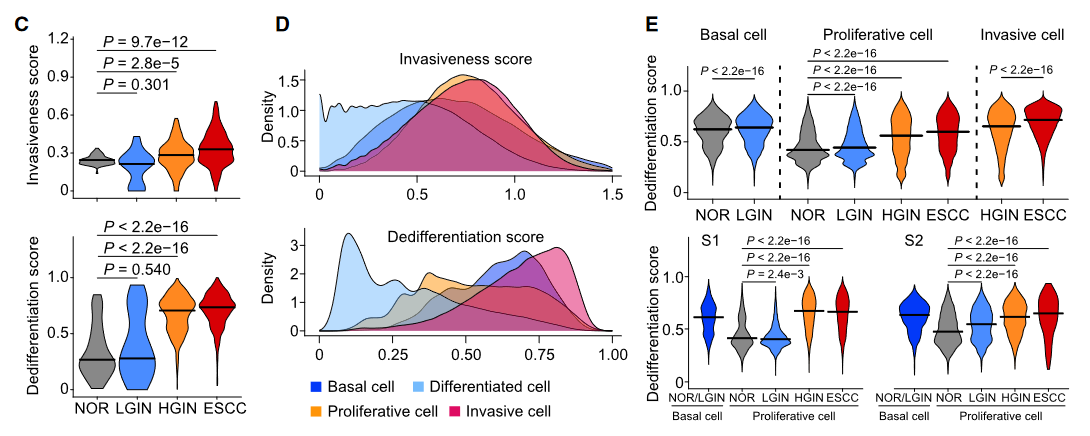
图3
3. CAF-Epi生态位形成免疫豁免微环境
时空规律(Fig 4):HGIN期:侵袭细胞通过JAG1-NOTCH1信号招募正常成纤维细胞(NFs)转化为癌相关成纤维细胞(CAFs)。ESCC期:CAFs密度激增(NOR 0.12 → ESCC 5.77),与侵袭细胞共定位形成CAF-Epi生态位(肿瘤边缘富集)。
机制验证:空间邻近性分析:距离侵袭细胞<10μm的成纤维细胞CAF转化率最高(*p*<10⁻⁷)(Fig 4E)。类器官共培养:ESCC细胞过表达JAG1 → 激活NFs迁移(*p*=1.2e⁻¹⁴)及CAF标记物(FAP/αSMA)上调。Notch1基因敲除小鼠:显著减少ESCC病变(Fig 5F),证实Notch信号是CAF转化的核心驱动。
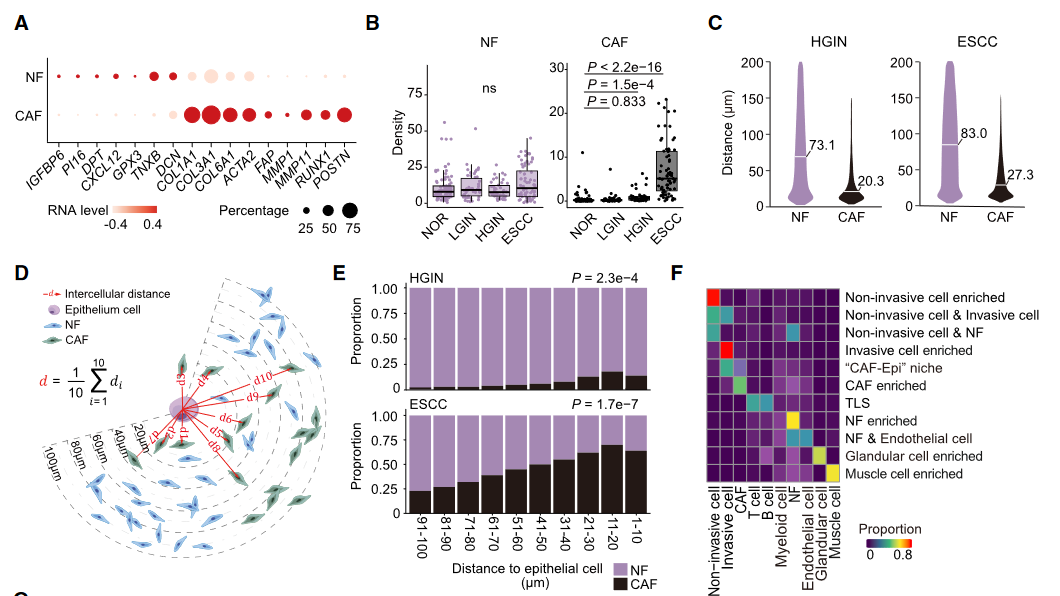
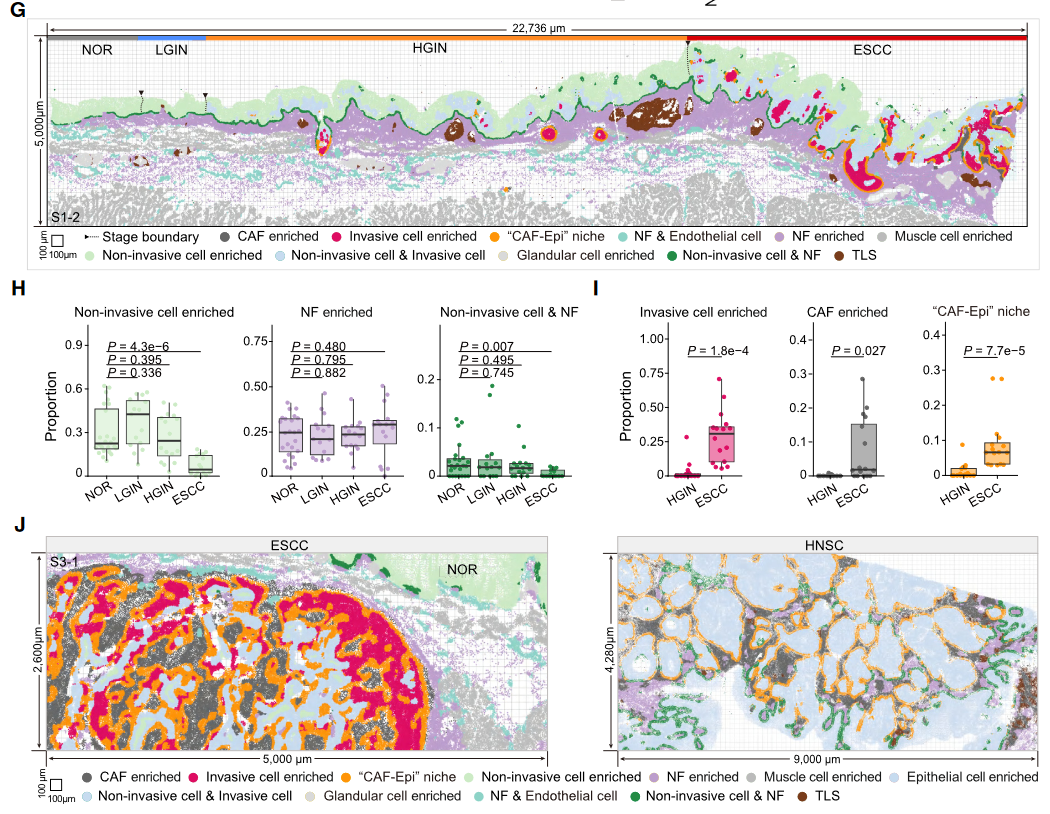
图4
3. 免疫微环境重塑
免疫抑制屏障形成(Fig 6):CAF-Epi生态位诱导ECM重塑(胶原I/III沉积),在肿瘤边缘形成物理屏障(250μm厚)。屏障内T细胞耗竭:CD8⁺效应T细胞密度下降(HGIN→ESCC, *p*=2.6e⁻⁷),Tregs(*p*=3.9e⁻⁷)和SPP1⁺巨噬细胞(*p*=4.0e⁻¹³)扩增。跨癌种保守性:在头颈鳞癌(HNSC)中同样观察到CAF-Epi生态位及ECM屏障(Fig 6F-G)。

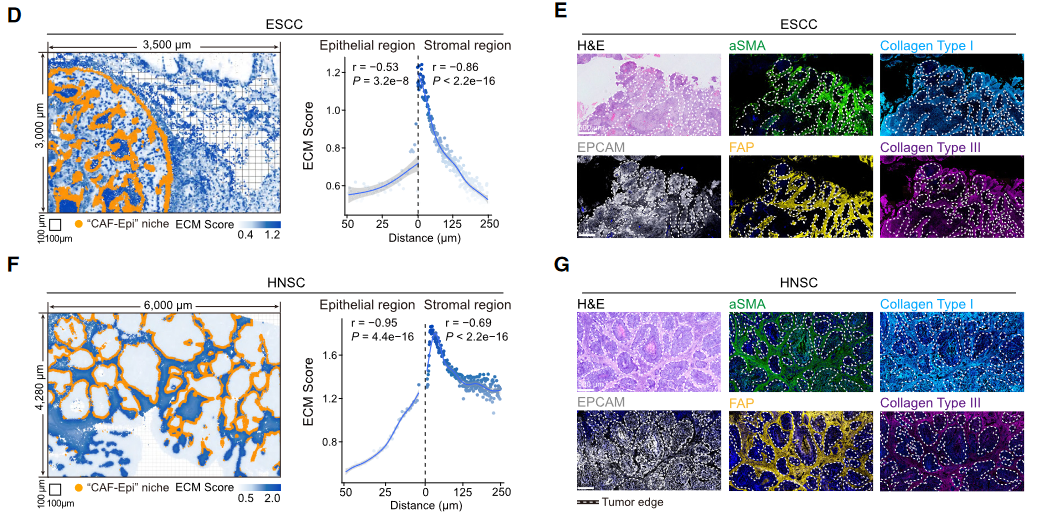
图6
4. 临床转化价值评估
诊断标志物:侵袭性评分(19基因)和CAF评分(7基因)从HGIN期显著升高(Fig 7B),可辅助病理分期。预后模型:CAF-Epi-免疫评分(26基因)在ESCC队列(n=316)中预测生存(HR=1.74, *p*=2.4e⁻⁹),且适用于HNSC/LUSC/CESC等鳞癌(Fig 7F-G)。治疗靶点:靶向JAG1-NOTCH1-CXCL1/8轴可阻断CAF转化(小鼠模型验证),或逆转免疫抑制微环境。
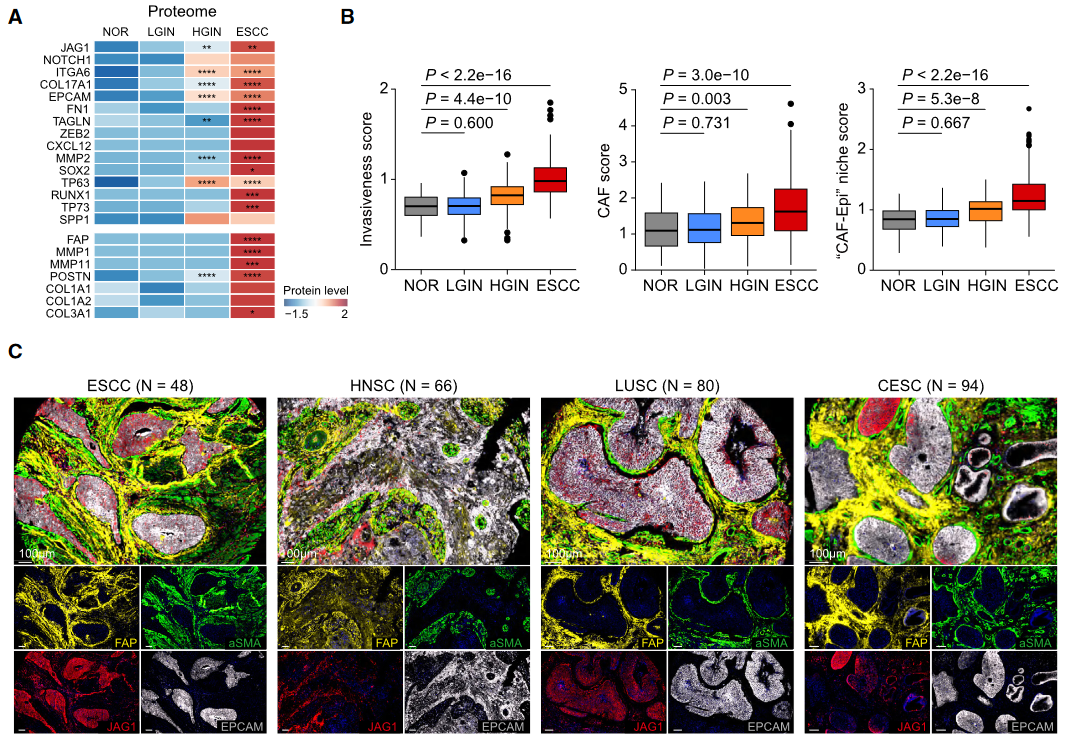
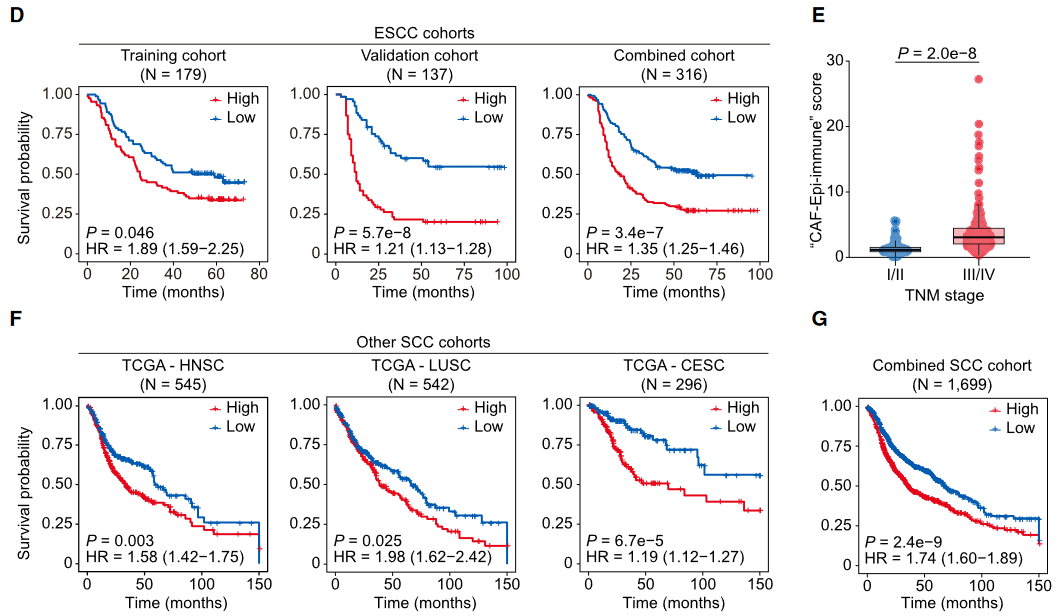 图7
图7
总结
本研究通过多阶段空间转录组图谱,揭示ESCC发生中上皮细胞去分化到间质浸润到CAF生态位形成再到免疫豁免的级联机制,为鳞癌早期干预提供新靶点(如JAG1-NOTCH1抑制剂),其构建的"CAF-Epi生态位"模型是理解实体瘤免疫逃逸的通用框架。技术局限与展望:基因覆盖局限:Panel未覆盖全转录组,可能遗漏稀有细胞亚群。CAF异质性:未区分myCAF/iCAF亚型(仅用FAP/αSMA标记)。动态追踪:需类器官活体成像等技术解析生态位形成实时动态。
参考文献:
Chang J, Lu J, Liu Q, Xiang T, Zhang S, Yi Y, Li D, Liu T, Liu Z, Chen X, Dong Z, Li C, Yi H, Yu S, Huang L, Qu F, Wang M, Wang D, Dong H, Cheng G, Zhu L, Li J, Li C, Wu P, Xie X, Teschendorff AE, Lin D, Wang X, Wu C. Single-cell multi-stage spatial evolutional map of esophageal carcinogenesis. Cancer Cell. 2025 Mar 10;43(3):380-397.e7. doi: 10.1016/j.ccell.2025.02.009. PMID: 40068596.
